Existem dois tipos principais de misturas, as heterogéneas e as homogéneas, para separar as várias misturas tem de haver vários tipos de separação de misturas,elas são:
(Misturas Heterogéneas)
-Separação Magnética, consiste em usar um íman para extrair o material magnético da mistura;
-Sublimação, utiliza-se para separar uma substância sólida que sublime facilmente do resto da mistura;
-Decantação com ampola, permite separar líquidos com densidades diferentes;
-Decantação, separa várias partículas no seio de uma solução;
-Filtro, consiste em passar um sólido ou líquido por um filtro, que retém partículas sólidas;
-Centrifugação, permite separar, através da rotação a alta velocidade, as partículas sólidas de pequenas dimensões que se encontram no líquido. Para a separação final utiliza-se a decantação;
(Misturas Homogéneas)
-Ebulição do Solvente, é um processo que permite extrair um sólido adicionando um liquido que o dissolva, seguido pela sua ebulição de modo a separar esse sólido da mistura;
-Destilação Simples, consiste na ebulição, seguida da condensação dos vapores formados,utiliza-se quando os vários componentes da mistura têm diferentes pontos de ebulição;
-Destilação fracionada, consiste em separar dois liquidos com pontos de ebulição muito próximos, fazendo-os destilar por ordem do ponto de ebulição;
-Cristalização, permite recuperar superar um sólido cristalino que está dissolvido num líquido ou purificar uma substância, através da evaporação ou arrefacimento;
-Cromatografia, técnica utilizada quando à pouca quantidade da amostra da mistura, coloca-se a mistura num papel de filtro e mergulha-se num solvente adequado.






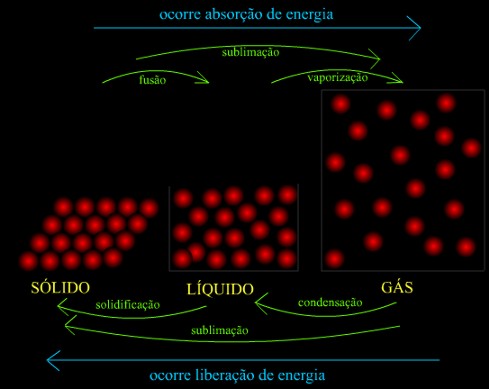



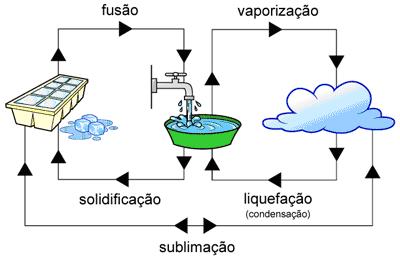 A vaporização pode ocorrer no estado de uma ebulição ou evaporação, a diferença é que a evaporação ocorre naturalmente e lentamente e a ebulição ocorre por meios artificiais e é mais rápida, começando a borbulhar antes do liquido evaporar.
A vaporização pode ocorrer no estado de uma ebulição ou evaporação, a diferença é que a evaporação ocorre naturalmente e lentamente e a ebulição ocorre por meios artificiais e é mais rápida, começando a borbulhar antes do liquido evaporar.
